Il dolore neuropatico alle gambe associato a lombosciatalgia non è sempre persistente: è quanto si apprende da un articolo apparso sul “Journal of Pain”…

Cannabis terapeutica galenica. Uno studio osservazionale nella regione Veneto
Beniamino Palmieri1,2, Caterina Fanelli2, Francesco Crestani3, Angela Bassan4, Maria Vadalà1,2
1 Dipartimento Chirurgico, Odontoiatrico e di Scienze Morfologiche con Interesse Trapiantologico, Oncologico e di Medicina Rigenerativa, Università degli Studi di Modena e Reggio Emilia, Modena 2 Network del Secondo Parere, Modena 3 Ospedale San Luca, Trecenta, Rovigo 4 Farmacia Ospedaliera di Rovigo
Abstract
OBIETTIVO: Questo studio retrospettivo, aperto, aneddotico, spontaneo, osservazionale, compassionevole analizza le proprietà terapeutiche della cannabis e le possibili applicazioni in disturbi di diversa entità, i cui benefici sono individualmente variabili e dipendono anche dalle diverse concentrazioni del principio attivo, presenti al momento della estrazione, nella pianta e dalla via di somministrazione. I preparati galenici somministrati sono a base di Cannabis sativa contenenti delta-9-tetraidrocannabinolo (THC) e cannabidiolo (CBD) in concentrazioni variabili (<1% al 22% di THC e <1% al 12% di CBD) per le titolazioni in forma di cartine e capsule; THC free e CBD dal 2,5% al 50% in forma di olio.
METODI: Hanno fatto parte di questo studio 109 pazienti (60% uomini e 40% donne, di età compresa tra i 30 e i 70 anni) affetti da patologie polimorfe, afferenti al Network del Secondo Parere, trattati con cannabinoidi per sei mesi, che avevano dimostrato risposta insoddisfacente al trattamento con farmaci convenzionali. I pazienti sono stati istruiti ad assumere le formulazioni proposte inizialmente in una somministrazione solo la sera, in seguito ogni 8 o 12 ore; l’olio è stato somministrato in 1-2 gocce fino ad arrivare ad un massimo di 30.
RISULTATI: Dopo sei mesi di trattamento quasi tutti i pazienti hanno dichiarato di aver avuto benefici superiori ed immediati rispetto alle terapie convenzionali, in parallelo ad un significativo miglioramento della sintomatologia, valutata con la scala di Scott-Huskisson.
CONCLUSIONI: L’azione sinergica del fitocomplesso ha migliorato le funzionalità motorie in individui affetti da patologie degenerative, oltre ad aver contrastato efficacemente i sintomi dolorosi nelle patologie oncologiche e nei disturbi neuropatici cronici, dimostrando uno spiccato effetto antalgico e rivelandosi vantaggioso quanto ad efficacia.
Introduzione
In letteratura sono presenti diversi contributi scientifici non sistematici riguardanti l’utilizzo di questo principio attivo, in numerose patologie, quali: sindrome da immunodeficienza acquisita (AIDS) [1]; Morbo di Crohn [2]; colite ulcerosa [3]; sindromi da astinenza nelle dipendenze [4]; glaucomi [5]; fibromialgia [6]; dolori articolari determinati da artriti e malattie autoimmuni [7]; sclerosi multipla (SM) [8]; insonnia [9]; morbo di Parkinson [10]; morbo di Alzheimer [11]; epilessia [12]; leucemia, cancro alla prostata, seno, cervello, esofago e linfoma [13, 14]; disturbo da stress post traumatico [15]; endometriosi [16].
In glaucomi resistenti alle terapie convenzionali, è stato dimostrato che una singola applicazione topica di THC ha abbassato la pressione intraoculare (IOP) [5]; nel trattamento della fibromialgia, la cannabis si è dimostrata una comprovata strategia terapeutica alternativa. Habib et al. [17], tramite un questionario online, hanno campionato 2.705 persone totali. Il 94% dei consumatori di cannabis (CC) ha riportato sollievo dal dolore, migliore qualità del sonno, miglioramento della depressione e miglioramento dello stato d’ansia.
Il marcato effetto antitumorale, ascrivibile al fitocomplesso, è rilevabile nello studio di Jeong et al. [18], che individua il CBD come causa dell’aumento della sintesi dei ROS e dello stress del reticolo endoplasmatico, attivando la produzione di Noxa, la quale ha comportato la successiva stimolazione delle caspasi, con conseguente apoptosi delle cellule tumorali del colon-retto (Figura 1).
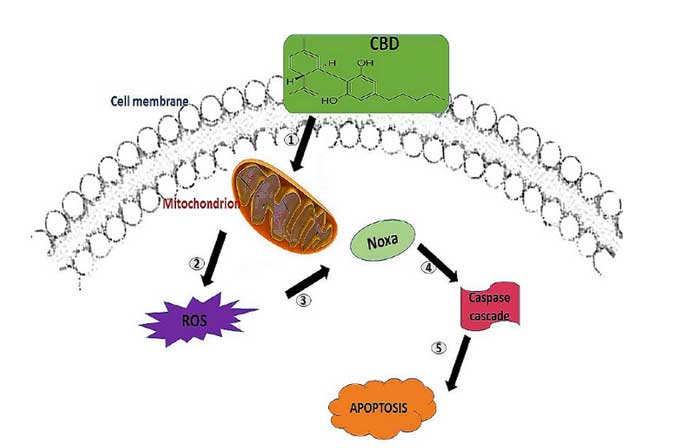
Figura 1. Meccanismo del CBD nell’indurre l’apoptosi. (1) Il CBD si lega ai recettori centrali e periferici
sulla membrana cellulare; (2) ciò provoca lo stress mitocondriale e la produzione di specie reattive dell’ossigeno (ROS)
(3) attivazione di Noxa, e quindi (4) l’attivazione a cascata della caspasi, che si traduce in (5) apoptosi.
Dimakatso R. et al. International Journal of Molecular Sciences.
Ricerche recenti [19] hanno valutato l’utilizzo della terapia fotodinamica (PDT), non invasiva e selettivamente citotossica per le cellule cancerose, in associazione con il CBD che lega i recettori dei cannabinoidi accoppiati alle proteine G (CB1R e CB2R), up-regolati nel cancro. Nel carcinoma mammario, CB2R è sovraespresso e il legame del CBD con il CB2R impedisce la progressione del tumore e le metastasi. La PDT, al contrario, provoca la morte delle cellule tumorali che, se combinate con l’effetto iniziale causato dal CBD, rende concepibile l’eradicazione completa delle cellule tumorali.
Scopo della nostra indagine è stato rilevare e accertare gli effetti terapeutici e collaterali della somministrazione di cannabinoidi su un campione di popolazione preso dall’ULSS 5 Polesana di Rovigo (RO).
Materiali e metodi
In questo studio osservazionale, retrospettivo, aperto, aneddotico, spontaneo, tramite il Network del Secondo Parere, sono stati arruolati 109 pazienti, di età compresa tra i 30 e i 70 anni (60% uomini e 40% donne) presso l’ULSS 5 Polesana di Rovigo, tra il 2016 ed il 2018. La totalità di costoro aveva in corso mediamente 5-6 mesi di assunzione della terapia magistrale.
Il Network del Secondo Parere è essenzialmente un servizio consultivo per casi clinici complessi, non risolti adeguatamente, oppure non sufficientemente soddisfatti sotto il profilo della diagnosi e/o della terapia prescritta per risolvere un problema di salute e conseguirne possibilmente guarigione o miglioramento della qualità della vita, ricorrendo in tempo reale anche ad un panel di esperti specialisti, sotto la guida di una regia unificata [8, 9, 10]. In molte malattie a decorso cronico, dopo ripetuti trattamenti, i pazienti vanno alla ricerca di nuovi principi attivi, in un turnover che passa attraverso il web, diretto a svariati specialisti con i più diversi approcci terapeutici in una forma di ricerca ripetitiva e talora ossessiva che abbiamo definito web Babel Syndrome (“sindrome di Babele del web”) [20].
Il Grafico 1 riassume le patologie dei 109 soggetti considerati, trattati con prodotti a base di cannabis: dolore reumatico di natura incerta con un quadro clinico complesso (19,6%); fibromialgia (17,5%); epilessia resistente ai farmaci convenzionali (11,5%); dolore cronico proveniente da diverse cause (10,3%); lombalgia cronica (7%); dolori oncologici (6,2%); nausea, cachessia e sclerosi multipla (4%); neuropatie (5%); rizotomia (1%); morbo di Parkinson (3%); paralisi cerebrale infantile (3%); sclerosi laterale amiotrofica (2%); insonnia, sofferenza correlata ad ipossia neonatale e colite ulcerosa (1%).
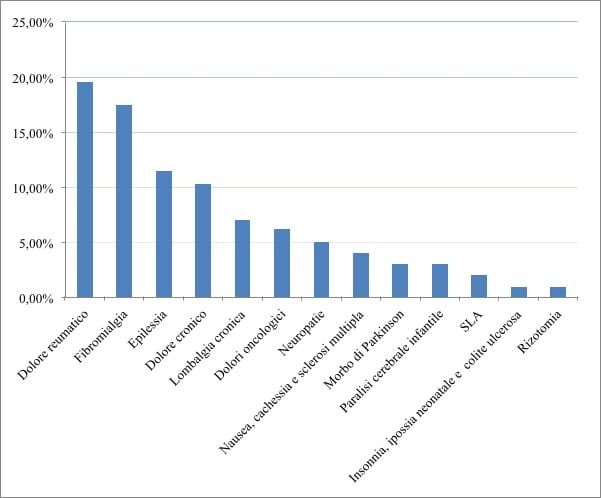
Grafico 1. Patologie di cui soffrono i pazienti del campione considerato.
I dati personali di tutti i pazienti, la patologia di cui soffrivano, la terapia prescritta di cui si dichiaravano insoddisfatti, gli effetti collaterali ed indesiderati erano raccolti dalla scheda di eleggibilità compilata dal medico.
La terapia assunta dai pazienti campionati prevedeva la prescrizione di preparati galenici (cartine e/o capsule), a base di:
- THC 6,5%, CBD 9%;
- THC 7,5-8%; CBD 8-12%;
- THC <1%, CBD 8%;
- THC 19-22%, CBD <1%;
- THC free, CBD dal 2,5% al 50% (in forma di olio).
Il dosaggio di partenza era 50 mg per le cartine e le capsule, contenenti Cannabis Flos, e 0,1g/ml per l’olio; in base alla risposta del paziente si aumentava il dosaggio, inizialmente era prevista una singola somministrazione la sera e poi ogni 8 o 12 ore; l’olio, somministrato in 1-2 gocce, poteva essere elargito fino ad un massimo di 30.
Il Grafico 2 indica la titolazione maggiormente prescritta.
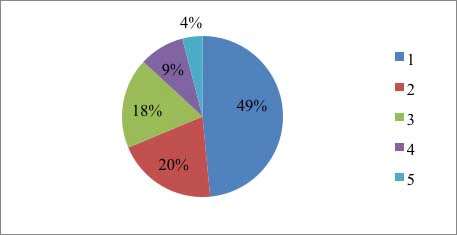
Grafico 2. Terapia somministrata. Nel grafico è riportata la terapia somministrata al campione di pazienti, espressa in percentuale.
Le cartine e le capsule, prescritte rispettivamente nel 18% e nel 15% dei casi, contenenti le infiorescenze di cannabis sono state allestite nel laboratorio della Farmacia Ospedaliera, assunte per via orale, o tramite decozione, o per via inalatoria tramite evaporazione entro le 24 ore. L’olio è la forma farmaceutica maggiormente prescritta (67%), assunto per via sub-linguale, è stato preparato in una farmacia esterna ed è la formulazione più indicata, garantisce un’estrazione migliore dei principi attivi e una migliore biodisponibilità [21].
I benefici del trattamento sono stati misurati anamnesticamente prima e dopo sei mesi con scala di Scott-Huskisson, da parte del paziente e da parte del medico. La valutazione globale dell’efficacia del trattamento è stata valutata: a) nulla=0; b) scarsa=1; c) lieve=2; d) buona= 3; e) ottima= 4; f) eccellente=5.
L’andamento della malattia, in relazione alla terapia somministrata, è stato valutato tramite dialogo telefonico nel corso del follow-up.
Risultati
Dopo sei mesi di trattamento con la cannabis, abbiamo osservato che dei 109 casi totali, 16 soggetti (16,2%) con dolore reumatico manifestano un quadro sintomatologico migliorato, due pazienti (12,5%) hanno assunto la cannabis come monoterapia, un solo caso risulta peggiorato (6,5%) dichiarando di avere dolore più accentuato rispetto alla condizione iniziale e il 12,5% dei soggetti (2 pazienti) non ha manifestato alcun miglioramento.
Tra i 16 casi affetti da fibromialgia, 12 (75%) hanno dichiarato efficacia terapeutica globale con cannabinoidi mentre il 12,5% (2 pazienti) ne ha tratto vantaggio esclusivamente sul sintomo dolore.
In un totale di 11 soggetti epilettici (11,3%), 9 (81%) hanno riferito un miglioramento della qualità della vita, di cui il 9% (1 paziente) ha sostituito gli anticonvulsivanti con la cannabis.
Quanto al dolore cronico, 10 pazienti affetti (10,30%), 6 casi (60%) hanno integrato la terapia già somministrata a base di analgesici con trattamento a base di cannabis traendone relativo beneficio.
Quanto a lombalgia cronica, su 7 pazienti totali (7,2%) l’85,7% (6 soggetti) ha riferito un miglioramento sintomatico, accusando meno dolore rispetto alla condizione di partenza; 5 pazienti (5,1%) dei 7 totali (7,2%), che accusavano dolore oncologico ha sortito effetto analgesico mentre il 28,5 % (2 casi) non ha riscontrato beneficio; il 4,1% dei pazienti oncologici (4 casi) che accusavano nausea e cachessia ha dichiarato sollievo dai sintomi; dei 4 soggetti (4,10%) affetti da dolore neuropatico il 75% (3 casi) ha risposto positivamente al trattamento antalgico con i cannabinoidi; mentre un singolo paziente sottoposto a rizotomia non ha riscontrato effetti benefici; dei 4 casi (4,10%) affetti da sclerosi multipla, si è osservato un beneficio nel 75% dei pazienti trattati (3 casi); mentre nel trattamento di 3 pazienti affetti dal Morbo di Parkinson (3,1%) ha dato al 100% risultati benefici immediati; nessun miglioramento invece nei 3 soggetti con paralisi cerebrale infantile (3,1%), ipossia prenatale (1%) e insonnia (1%); il soggetto con colite ulcerosa (1%) ha migliorato il quadro addominale subiettivo e obiettivo; il paziente affetto da SLA non ha riscontrato alcun beneficio, ma neppure alcun effetto collaterale (Grafico 3).
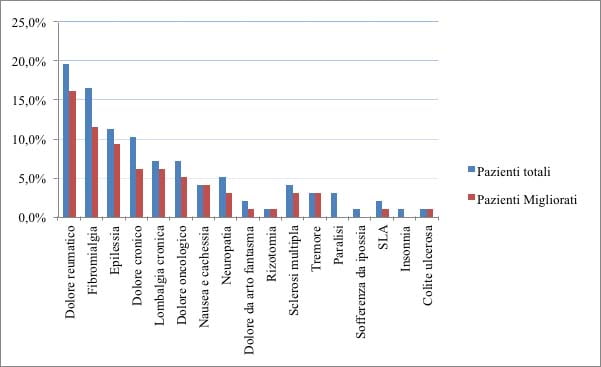
Grafico 3. Valutazione dell’efficacia del trattamento. Confronto tra il totale dei pazienti campionati
e il totale dei pazienti migliorati dopo sei mesi di assunzione della terapia galenica a base di cannabis.
Globalmente il 93,5% dei pazienti non ha accusato effetti collaterali da cannabis, solo il 6,5% (7 persone) ha accusato confusione mentale, turbe del sonno, nausea, stanchezza e difficoltà nel concentrarsi con associata riduzione della memoria. Il trattamento antalgico con cannabinoidi è risultato quindi sicuro e ben tollerato dalla quasi totalità dei pazienti.
In tema di compliance a lungo termine, il 21% dei soggetti assume le preparazioni magistrali da un anno, il 13% ne fa uso da 2 anni.
Dopo sei mesi, su 109 casi totali, i sintomi precedenti alla terapia globalmente intesi sono migliorati nel 73% degli individui, mentre il 27% risulta non aver riscontrato nessun beneficio (Grafico 4).
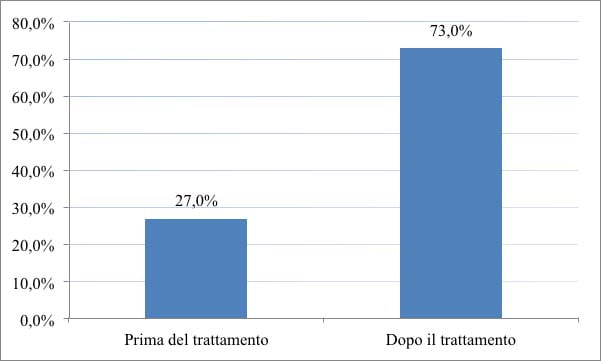
Grafico 4. Miglioramento della terapia. Valutazione prima e dopo il trattamento.
I risultati della valutazione dell’efficacia dopo 6 mesi di trattamento, valutati dal paziente in seguito ai benefici sui sintomi misurati con la scala di Scott-Huskisson e dal medico in seguito a valutazione obiettiva con visita del paziente e dei risultati delle analisi effettuate, sono riassunti nel Grafico 5: 12 soggetti hanno riferito efficacia nulla, 8 hanno definito la terapia galenica di scarsa efficacia, nessun paziente ha riferito una lieve efficacia, 67 casi hanno riferito una buona efficacia percependo una sensazione di benessere fisico, nessun paziente ha definito la terapia ottima, 8 pazienti hanno definito come eccellente la cura magistrale con cannabinoidi. Il medico ha riportato in 5 casi efficacia nulla, in 4 casi una scarsa efficacia, in 4 soggetti una efficacia lieve, in 70 pazienti una efficacia buona, in 4 casi l’efficacia si è dimostrata ottima e in 10 soggetti una eccellente efficacia.
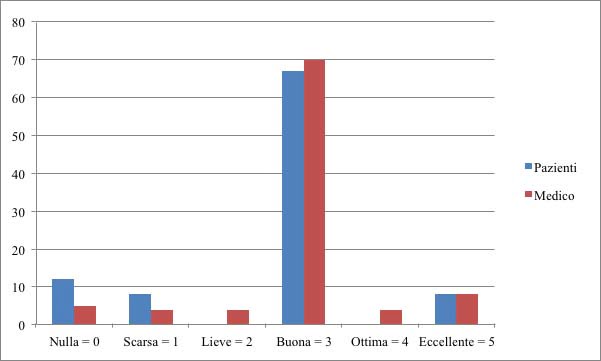
Grafico 5. Valutazione dell’efficacia del trattamento secondo il giudizio dei pazienti e del medico,
misurato con la scala di Scott-Huskisson.
Conclusioni
Questo studio pilota ha dimostrato che, nel controllo a 6 mesi di trattamento con i cannabinoidi, nel campione osservato, venivano riscontrati consolidati benefici, stimati con doppia valutazione subiettiva e obiettiva e considerando anche mutuali miglioramenti biochimico-strumentali.
La somministrazione a breve termine di cannabinoidi è stata ben tollerata ed efficace nel ridurre i sintomi tra cui dolore, rigidità e spasmi muscolari, in concomitanza con o senza terapie convenzionali.
I partecipanti allo studio non hanno riportato alcun evento avverso psicoattivo potenzialmente collegato ai cannabinoidi, come euforia, sonnolenza, confusione, memoria a breve termine o perdita di concentrazione. In effetti, nella maggior parte dei pazienti si notano miglioramenti significativi nella qualità del sonno e dell’umore.
Il sollievo da spasmi muscolari e insonnia e i sintomi correlati alla SM potrebbero essere associati all’attività antinfiammatoria del CBD. La significativa riduzione del dolore e della rigidità nei pazienti con FM potrebbe essere dovuta all’azione modulante dei recettori CB e, in particolare, dell’asse ipotalamo-ipofisi-surrene.
Dal punto di vista economico, è opportuno sottolineare che i laboratori galenici delle farmacie sono gravati da costi aggiuntivi di titolazione della cannabis con cromatografia liquida o gassosa e spettrometria di massa, il che accentua ulteriormente il peso economico sul paziente dovendo queste indagini essere eseguite al di fuori, dato che solitamente non è provvista di tale strumentazione. A ciò si aggiunga l’acquisto di un vaporizzatore per inalare materiale vaporizzato da parte dei pazienti, manovra del tutto soggettiva gravata da un alta variabilità di assorbimento dei principi attivi e quindi con variabili di efficacia. Inoltre, l’onere economico dei pazienti rappresenta non di rado, anche in questa casistica, un motivo di drop out dallo studio a prescindere dalla efficacia del trattamento.
Ulteriori studi randomizzati controllati sono certamente auspicabili in quanto resta da stabilire se gli effetti di queste cure si mantengano nel lungo periodo anche con intervalli di sospensione, mentre non emerge dalle nostre osservazioni alcuna reale dipendenza psicologica o psicofisica, ma una semplice propensione e gradimento quando la terapia sia percepita dal paziente come efficace.
La sua sospensione non ha comportato, in questa casistica, recrudescenza o sindrome da astinenza, talora mantiene attenuati i sintomi, più acutamente recepiti prima, o comunque li ripresenta quo ante invariati.
BIBLIOGRAFIA
Jennifer A. Manuzak, Toni M. Gott, Jay S. Kirkwood, Ernesto Coronado, Tiffany Hensley-McBain, Charlene Miller, Ryan K. Cheu, Ann C. Collier, Nicholas T. Funderburg, Jeffery N. Martin, Michael C. Wu, Nina Isoherranen, Peter W. Hunt and Nichole R. Klatt. Heavy Cannabis Use Associated With Reduction in Activated and Inflammatory Immune Cell Frequencies in Antiretroviral Therapy–Treated Human Immunodeficiency Virus–Infected Individuals. Clin Infect Dis. 2018 Jun 15; 66(12): 1872–1882.
Timna Naftali, Lihi Bar-Lev Schleider, Iris Dotan, Ephraim Philip Lansky, Fabiana Sklerovsky Benjaminov, Fred Meir Konikoff. Cannabis Induces a Clinical Response in Patients With Crohn’s Disease: A Prospective Placebo-Controlled Study. Clinical Gastroenterology and Hepatology 2013;11:1276–1280.
Waseem Ahmed, Seymour Katz. Therapeutic Use of Cannabis in Inflammatory Bowel Disease. Gastroenterol Hepatol (N Y). 2016 Nov; 12(11): 668–679.
Luján MÁ, Castro-Zavala A, Alegre-Zurano L, Valverde O. Repeated Cannabidiol treatment reduces cocaine intake and modulates neural proliferation and CB1R expression in the mouse hippocampus. Neuropharmacology. 2018 Dec;143:163-175. Epub 2018 Sep 28.
Sally Miller, Laura Daily, Emma Leishman, Heather Bradshaw, and Alex Straiker. Δ9-Tetrahydrocannabinol and Cannabidiol Differentially Regulate Intraocular Pressure. Invest Ophthalmol Vis Sci. 2018 Dec; 59(15): 5904–5911.
Tine van de Donka, Marieke Niestersa, Mikael A. Kowalb, Erik Olofsena, Albert Dahana,*, Monique van Velzena. An experimental randomized study on the analgesic effects of pharmaceutical-grade cannabis in chronic pain patients with fibromyalgia. Pain. 2019 Apr;160(4):860-869.
Valeria Katchan, Paula David, Yehuda Shoenfeld. Cannabinoids and autoimmune diseases: A systematic review. Autoimmun Rev. 2016 Jun;15(6):513-28.
Jody Corey-Bloom, Tanya Wolfson, Anthony Gamst, Shelia Jin, Thomas D. Marcotte, Heather Bentley, and Ben Gouaux. Smoked cannabis for spasticity in multiple sclerosis: a randomized, placebo-controlled trial. CMAJ. 2012 Jul 10; 184(10): 1143–1150.
Vigil JM, Stith SS, Diviant JP, Brockelman F, Keeling K, Hall B. Effectiveness of Raw, Natural Medical Cannabis Flower for Treating Insomnia under Naturalistic Conditions. Medicines (Basel), 2018;5(3).
Marcos Hortes Chargas, Antonio W Zuardi, Vitor Tumas, Márcio Alexandre Pena-Pereira, Emmanuelle T Sobreira, Mateus M Bergamaschi, Antonio Carlos dos Santos, Antonio Lucio Teixeira, Jaime EC Hallak, José Alexandre S Crippa. Effects of cannabidiol in the treatment of patients with Parkinson’s disease: An exploratory double-blind trial. Journal of psychopharmacology (Oxford, England), 2014.
Constantine G. Lyketsos, Elizabeth Garrett, Kung-Yee Liang, and James C. Anthony. Cannabis Use and Cognitive Decline in Persons under 65 Years of Age. Am J Epidemiol Vol. 149, No. 9, 1999.
Wise J. European drug agency approves cannabis-based medicine for severe forms of epilepsy. BMJ. 2019 Sep 24;366:l5708.
D Vara, M Salazar, N Olea-Herrero, M Guzman, G. Velasco, Diaz-Laviada. Anti-tumoral action of cannabinoids on hepatocellular carcinoma: role of AMPK-dependent activation of autophagy. Cell Death Differ. 2011 Jul;18(7):1099-111.
Sean D. McAllister, Ryuichi Murase, Rigel T. Christian, Darryl Lau, Anne J. Zielinski, Juanita Allison, Carolina Almanza, Arash Pakdel, Jasmine Lee, Chandani Limbad, Yong Liu, Robert J. Debs, Dan H. Moore, and Pierre-Yves Desprez. Pathways mediating the effects of cannabidiol on the reduction of breast cancer cell proliferation, invasion, and metastasis. Breast Cancer Res Treat. 2011 Aug; 129(1): 37–47.
Elms L, Shannon S, Hughes S, Lewis N. Cannabidiol in the Treatment of Post-Traumatic Stress Disorder: A Case Series. J Altern Complement Med. 2019 Apr;25(4):392-397.
Armour M, Sinclair J, Chalmers KJ, Smith CA. Self-management strategies amongst Australian women with endometriosis: a national online survey. BMC Complement Altern Med. 2019;19(1):17.
George Habib and IritAvisar. The Consumption of Cannabis by Fibromyalgia Patients in Israel. Pain Research and Treatment Volume 2018, Article ID 7829427, 5 pages.
Jeong, S.; Yun, H.K.; Jeong, Y.A.; Jo, M.J.; Kang, S.H.; Kim, J.L.; Kim, D.Y.; Park, S.H.; Kim, B.R.; Na, Y.J.; et al. Cannabidiol-induced apoptosis is mediated by activation of Noxa inhuman colorectal cancer cells. Cancer Lett. 2019 Apr 10;447:12-23.
Dimakatso R. Mokoena, Blassan P. George and Heidi Abrahamse. Enhancing Breast Cancer Treatment Using a Combination of Cannabidiol and Gold Nanoparticles for Photodynamic Therapy. Int J Mol Sci. 2019 Sep 26;20(19).
Palmieri B et al Second opinion clinic: is the Web Babel Syndrome treatable? Clin Ter 2011; 162: 575–583.
Russo EB, et al. Cannabis Therapeutics and the Future of Neurology. International Cannabis and Cannabinoids Institute (ICCI), Praga, Repubblica Ceca. Front Integr Neurosci, 2018;12:51.


